Selkeä esitys lämpöprosessista, joka selittää, miten ja miksi suola nopeuttaa juoman jäähtymistä muutamassa minuutissa.
Sisällysluettelo
Lämmin olut kesällä on eräänlainen kausittainen tragedia. Mutta mielenkiintoisinta on, että ratkaisu ei perustu monimutkaiseen tekniikkaan, vaan fysiikan lakeihin, jotka ovat yhtä yksinkertaisia kuin tehokkaita . Tarvitset vain jäätä, vettä, suolaa… ja vähän tiedettä. Tässä artikkelissa selitämme tiukalla mutta helppotajuisella lähestymistavalla, miksi tämä pullo saavuttaa ihanteellisen lämpötilan vain muutamassa minuutissa . Avain löytyy faasimuutoksesta ja hyvin yksinkertaisesta kaaviosta.
Tämä aihe on jo käsitelty edellisessä artikkelissa, jossa selitettiin vaihe vaiheelta, kuinka jäähdytetään olutta nopeasti jäällä, vedellä ja suolalla, ja annettiin käytännön ohjeita tämän soveltamiseen jokapäiväisissä tilanteissa. Tarkoituksena ei kuitenkaan ole toistaa tätä sisältöä, vaan mennä askelta pidemmälle: ymmärtää tarkemmin, miksi tämä toimii. Keskitytään siihen fysikaaliseen mekanismiin, joka tekee tämän mahdolliseksi – faasimuutokseen ja lämmönsiirtoon – ja siihen, kuinka yksinkertainen graafinen esitys voi auttaa meitä visualisoimaan koko prosessin selkeästi ja välittömästi.
Kylmä pullon fysiikka: jää todella ”lämpiää”
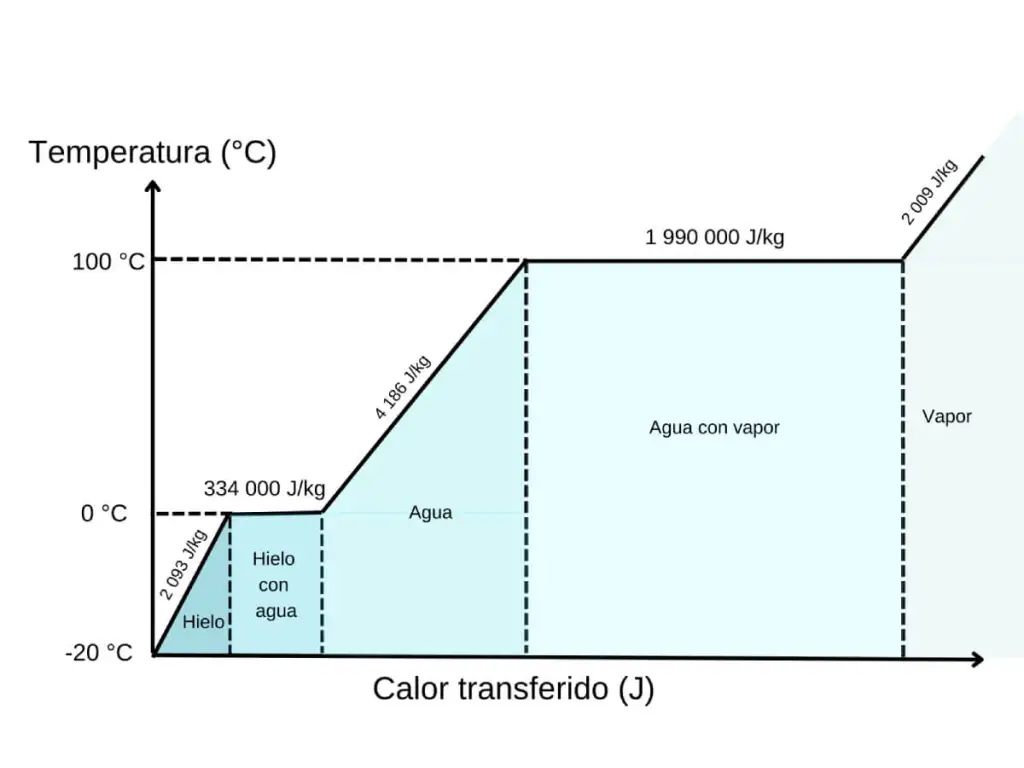
Kun asetamme huoneenlämpöisen pullon vesi-, jää- ja suolaseokseen, aktivoituu erittäin tehokas energian siirtomekanismi . Pääosassa on jää, jonka sulatessaan on imettävä lämpöä : tämä tunnetaan piilevänä sulamislämpönä . Mielenkiintoista on, että tämän prosessin aikana jään lämpötila ei nouse. Kaikki absorboitunut energia käytetään yksinomaan jään kiteisten rakenteiden tuhoamiseen, jotta se muuttuu nestemäiseksi vedeksi.
Jään sulamiseen tarvittava lämpö ei ilmesty tyhjästä. Se tulee välittömästä ympäristöstä, eli ympäröivästä vedestä ja olutpulloista. Käytännössä jää ”varastaa” lämpöä oluelta , jolloin sen lämpötila laskee nopeasti.
Sulamisen aikana jään lämpötila ei nouse, mutta se imee huomattavan määrän energiaa. Tämä kaavio osoittaa, kuinka järjestelmä pysyy 0 °C:ssa, kun siihen lisätään lämpöä, samalla kun jää muuttuu nestemäiseksi vedeksi. Tämä energia, joka tunnetaan piilevänä sulamislämpönä, käytetään kokonaan kiinteän aineen rakenteen tuhoamiseen ilman, että lämpötila nousee. Tämä on havainnollinen esimerkki siitä, kuinka faasimuutos vaatii energiaa, vaikka se ei näy lämpömittarissa.
Suolan rooli: jäätymispisteen säätely

Suolan lisääminen seokseen muuttaa toisen perustavanlaatuisen fysikaalisen ilmiön: kryoskooppisen laskun . Suolan lisääminen alentaa veden jäätymispistettä alle 0 °C. Tämä saa järjestelmän saavuttamaan alemmat lämpötilat ennen kuin jää lakkaa sulamasta. Joissakin tapauksissa seos voi vakiintua lämpötilaan noin –10 °C.
Tämä lisää lämpötilaeroa oluen ja sen ympäristön välillä, jolloin lämpö siirtyy vielä nopeammin pullon sisältä ulos.
(Laadukas) kaavio, joka selittää kaiken
Jos piirtäisimme kaavion järjestelmän lämpötilasta ajan funktiona , näkisimme aluksi maltillisen laskun, kun jää lisätään veteen. Mutta kun suolaa lisätään, jäähtyminen jatkuu alle 0 °C:n, vastoin intuitiota . Kaavio osoittaisi, kuinka lämpötila siirtyy asteittaisesta jäähtymisestä, joka näyttää pysähtyvän 0 °C:ssa, jatkuvaan jäähtymiseen juuri kun järjestelmä saavuttaa alle nollan lämpötilan.
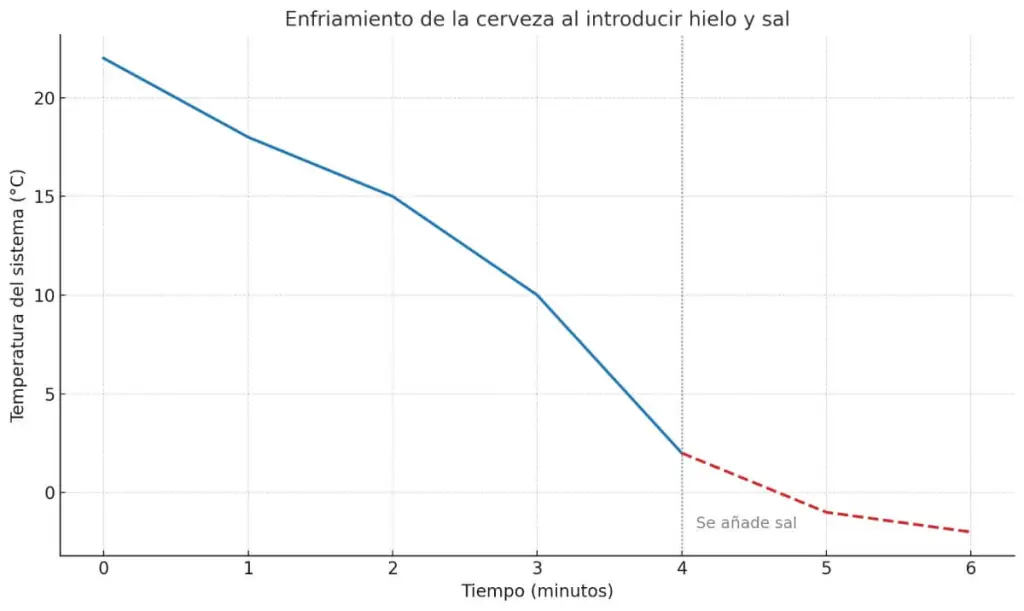
Tämä kaltevuuden muutos heijastaa järjestelmän lämpötehokkuutta: mitä suurempi lämpötilaero oluen ja sen ympäristön välillä on, sitä suurempi on lämmönsiirtonopeus. Ja jos ympäristö on veden jäätymispisteen alapuolella, vaikutus on vielä dramaattisempi.
Tämä käyrä on esitetty vain havainnollistamista varten, se ei vastaa todellista kokeilua ja sitä tulee käyttää vain tiedoksi.
Vesi lämmön johtimena
Toinen tärkeä tekijä tässä prosessissa on vesi. Vaikka se saattaa tuntua vähemmän jäähdyttävältä kuin jää, sen läsnäolo on välttämätöntä . Nestemäisenä vesi mukautuu täydellisesti pullojen muotoon ja täyttää kaikki aukot . Tämä takaa jatkuvan ja tasaisen kosketuksen kylmän ympäristön ja pullon pinnan välillä, maksimoiden lämmönsiirron lämmönjohtavuuden avulla.
Tämä vaikutus vahvistuu entisestään, jos käytetään murskattua jäätä , koska sen suuri kosketuspinta varmistaa tehokkaamman lämmönsiirron. Jokainen pieni jääpala toimii lämmön imeytymiskanavana, joka on paljon tehokkaampi kuin suuret jääkuutiot, jotka jättävät tyhjiä tiloja pullojen väliin.
Joten… mikä tämä käyrä on?: kylmä tasanne!
Se osoittaa, että jää ei muutu lämpötilaltaan välittömästi kuumennettaessa, vaan pysyy 0 °C:ssa, kunnes se sulaa. Tämä vaakasuora viiva, tämä tauko lämpötilan laskussa, on avain: vaikka ympäristö jatkaa jäähtymistä, jään on imettävä energiaa tuhotakseen kiinteän rakenteensa ja muuttuakseen vedeksi. Käyrä ei vain osoita laskua: se osoittaa muutoksen. Ja prosessin perustana on tämä tasanne .





